2025最新汇总 | 国内干细胞临床研究备案医院达148家、备案项目133个
以干细胞技术为代表的“再生医学技术”,是继药物治疗和手术治疗之后的“第三次医学革命”。干细胞是一种未充分分化、尚不成熟的细胞,具有再生为各种组织器官和人体细胞的潜能。是近年来国际医学前沿重点发展领域,为一些严重及难治性疾病带来了新的希望。
干细胞技术作为前沿科技领域的延伸,在美国、英国、加拿大、日本等国家优势突出,并已有产品上市进入市场。
为规范并促进我国干细胞临床研究,2015年7月20日,原国家卫生计生委、原国家食品药品监管总局以国卫科教发〔2015〕48号印发《干细胞临床研究管理办法(试行)》(下文简称《办法》),自发布之日起施行,从此我国干细胞开始走向按药品、技术管理的“双轨制”道路。
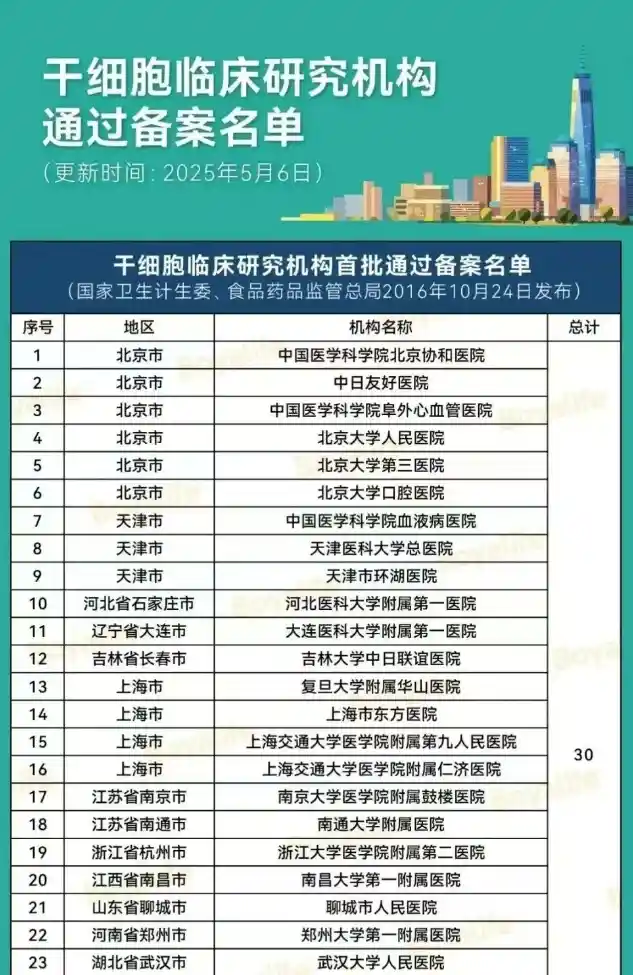
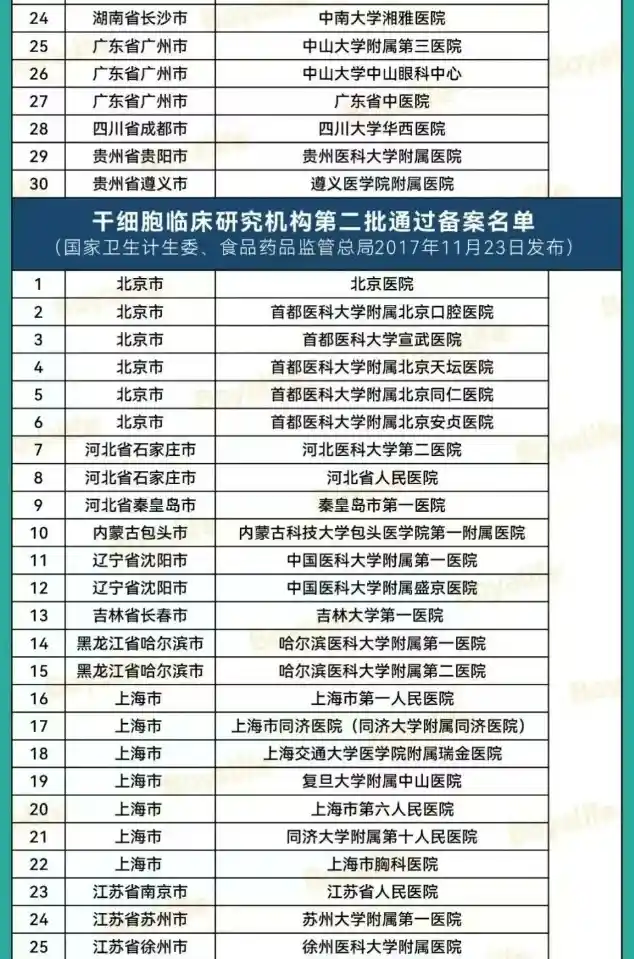
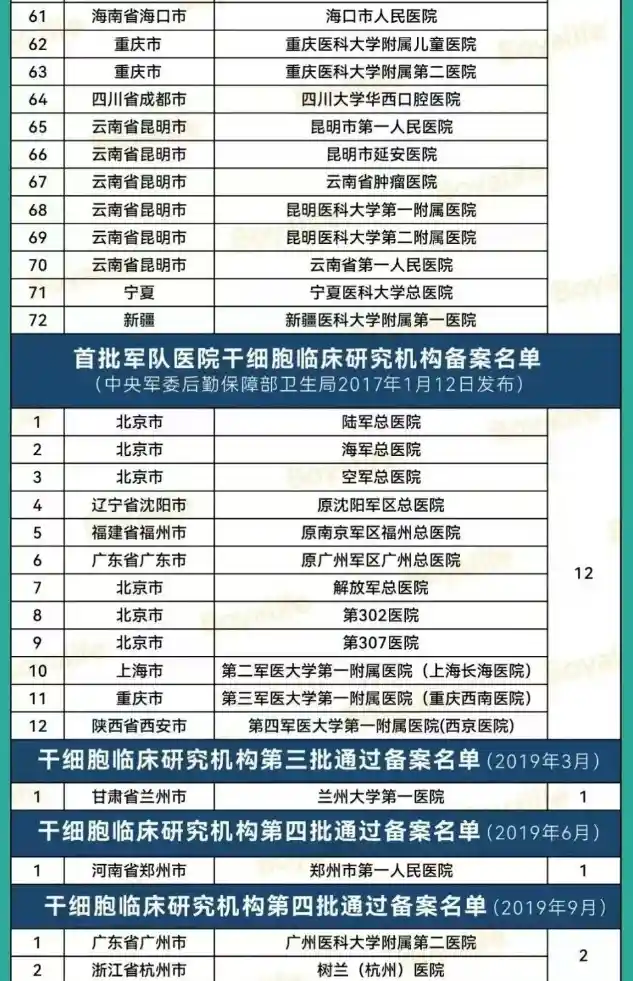
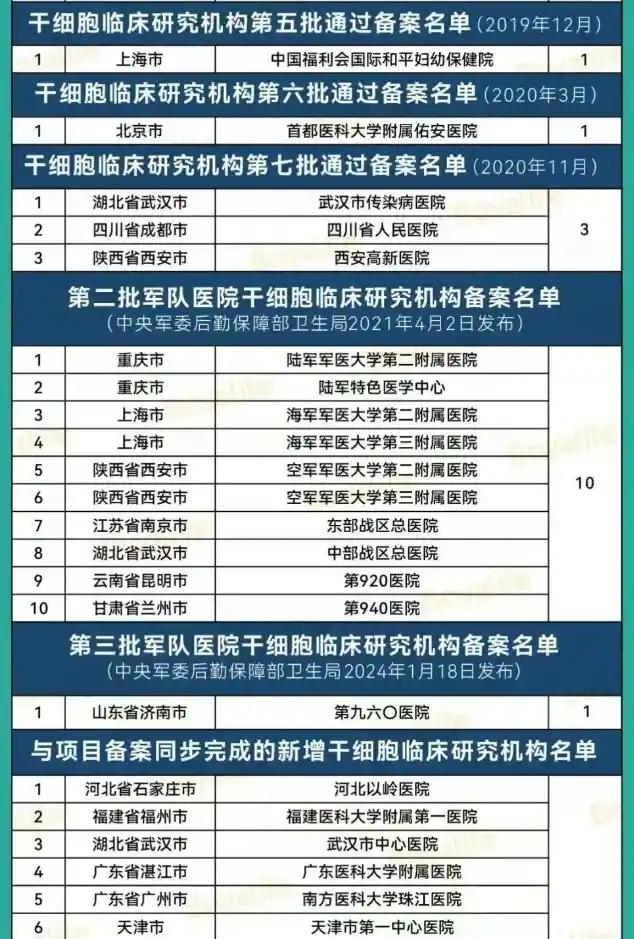
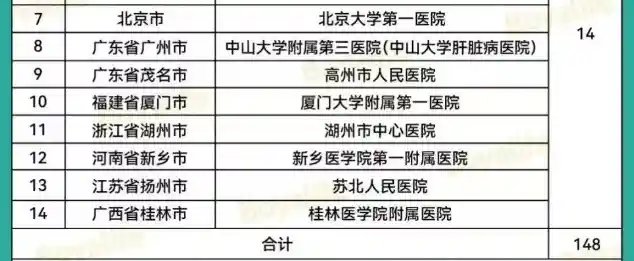
“双轨制”道路是指,企业的干细胞制剂鼓励按药品申报,由国家药品监督管理局(NMPA)监管;医疗机构主导的干细胞制剂研究,可按医疗技术进行管理,由国家卫健委监管。根据《办法》可知,干细胞临床研究需要由医疗机构发起,在完成医疗机构的临床研究资格备案和项目的备案(简称“双备案”)后,方可开展相关临床研究。截至2025年5月6日,国家医学研究登记备案平台有148家干细胞机构通过备案(其中军队医院23家),合计通过133个干细胞研究备案项目。具体名单如下:


 公众号二维码
公众号二维码
 小程序二维码
小程序二维码
